اقرأ في هذا المقال
- ثلاثي أكسيد ثنائي النتروجين
- خصائص ثلاثي أكسيد ثنائي النيتروجين
- استخدامات ثلاثي أكسيد ثنائي النيتروجين
- مخاطر ثلاثي أكسيد ثنائي النيتروجين
في الكيمياء إن مركب ثلاثي أكسيد ثنائي النتروجين وفي الإنجليزية: (Dinitrogen trioxide) عبارة عن مركب كيميائي غير عضوي، بالصيغة الكيميائية التالية: (N2O3)، له وزن جزيئي مقداره 76.011 غرام لكل مول، وهو سائل أزرق اللون ورائحته كريهة وحادة، نقطة الانصهار −100.7 درجة مئوية، نقطة الغليان 3.5 درجة مئوية، الكثافة 1.400 غرام لكل سم مكعب، يستخدم ثالث أكسيد ثنائي النيتروجين كوقود لأغراض خاصة بسبب طبيعته عالية الاحتراق.
ثلاثي أكسيد ثنائي النتروجين
- ثلاثي أكسيد ثنائي النتروجين هو مركب كيميائي غير عضوي له الصيغة الكيميائية التالية: (N2O3)، وهو سائل أزرق باهت، يعد أحد أكاسيد النيتروجين الثنائية، يتشكل عندما يتم خلط أجزاء متساوية من أكسيد النيتريك وثاني أكسيد النيتروجين، ثم تبريد الخليط إلى أقل من -21 درجة مئوية:
NO + NO2 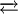 N2O3
N2O3
- ثلاثي أكسيد ثنائي النيتروجين له بنية مستوية، يتكون مركز الجزيء من ذرتين من النيتروجين مرتبطة برابطة واحدة، ترتبط ذرة نيتروجين واحدة بأكسجين واحد، وترتبط ذرتا الأكسجين الأخريان بذرة نيتروجين أخرى، لا يمكن عزل ثالث أكسيد ثنائي النيتروجين إلا في درجات الحرارة المنخفضة، أي في المرحلتين السائلة والصلبة.
- ثلاثي أكسيد ثنائي النتروجين مؤكسد قوي شديد السمية ومسبب للتآكل، وهومركب كيميائي يتكون من النيتروجين والأكسجين، ويسمى أيضًا سيسكوكسيد النيتروجين، يمتلك رابطة طويلة من (N – N) بطول رابطة يبلغ 186 بيكروميتر، وهو جزيء مستوٍ يعرض تناظر (Cs).
- يتفكك ثلاثي أكسيد ثنائي النتروجين جزئيًا إلى (NO2) و (NO)، يسبب تهيجًا شديدًا للجلد والأغشية المخاطية والعينين، ويمكن أن يكون استنشاق الأبخرة شديدة السمية، وهو أنهيدريد حامض النيتروز غير المستقر (HNO2)، وينتجه عند مزجه في الماء.
- من الممكن توقع بنية بديلة للأنهيدريد الحقيقي، أي (O = N-O-N = O)، ولكن لم يتم ملاحظة هذا الأيزومر، وإذا لم يتم استخدام حمض النيتروز بسرعة، فإنه يتحلل إلى أكسيد النيتريك وحمض النيتريك، ويتم إنتاج أملاح النتريت أحيانًا عن طريق إضافة ثلاثي أكسيد ثنائي النتروجين إلى محاليل القواعد:
N2O3 + 2 NaOH → 2 NaNO2 + H2O
خصائص ثلاثي أكسيد ثنائي النيتروجين
- ثالث أكسيد ثنائي النيتروجين يمتلك مظهر ديب بلو (أزرق غامق) ملون غازي، يمتلك الصيغة الكيميائية التالية: (N2O3)، الكتلة المولية 76.01 جم لكل مول، له نقطة الغليان 3.5 درجة مئوية، نقطة الانصهار −100.7 درجة مئوية، كما يمتلك كثافة مقدارها 1.4 جم لكل سم مكعب (سائل)، و 1.783 جم لكل سم مكعب (غاز).
- ثالث أكسيد ثنائي النيتروجين قابل للذوبان في الماء بدرجة عالية، وينتج ثالث أكسيد النيتروجين (HNO2) عند إضافته إلى الماء، وفي الحالة السائلة، وهو عامل مؤكسد حيث يستخدم كمؤكسد في أنظمة الوقود الخاصة، كما أن ثالث أكسيد ثنائي النيتروجين هو عبارة عن مادة غير قابلة للاشتعال ولكنها قد تسبب حرائق عند مزجها بمواد قابلة للاحتراق.
- يتفاعل ثالث أكسيد ثنائي النيتروجين مع عوامل الاختزال من أجل توليد الحرارة والمنتجات التي قد تكون غازية، حيث قد تكون المنتجات نفسها قادرة على مزيد من التفاعلات (مثل الاحتراق في الهواء)، كما أن ثالث أكسيد ثنائي النيتروجين يحفز اشتعال غاز الفوسفين.
استخدامات ثلاثي أكسيد ثنائي النيتروجين
- يتم استخدام ثالث أكسيد ثنائي النيتروجين كعامل مؤكسد، ويستخدم على نطاق واسع في تحضير مركبات النيتروجين الأخرى، كما أنه يساعد على ملء أغراض الوقود.
- إلى جانب ذلك فقد يتم استخدامه في المختبرات الكيميائية، كما ويستخدم ثالث أكسيد ثنائي النيتروجين في المساعدة في صناعات صنع الأصباغ والنايلون وما إلى ذلك.
مخاطر ثلاثي أكسيد ثنائي النيتروجين
- إن ثالث أكسيد ثنائي النيتروجين عبارة عن مركب سام ومسبب للتآكل، يمكن أن يكون قاتلاً إذا تم امتصاصه من خلال الجلد أو استنشاقه، أما عند تسخين ثالث أكسيد ثنائي النيتروجين فإنه ينتج غازات سامة مزعجة ومسببة للتآكل، عندما يتلامس شكله السائل فإنه يمكن أن يسبب إصابات خطيرة وحروقًا.
- ثالث أكسيد ثنائي النيتروجين سام وقد يكون قاتل إذا تم استنشاقه أو امتصاصه من خلال الجلد، حيث ينتج عن الحريق غازات مزعجة أو أكالة أو سامة، كما أن ثالث أكسيد ثنائي النيتروجين لا يحترق، ولكنه سيدعم الاحتراق، حيث تكون الأبخرة المنبعثة من الغاز المسال أثقل من الهواء وتنتشر على الأرض.
- ثالث أكسيد ثنائي النيتروجين مؤكسد قوي وسوف يتفاعل بقوة أو بشكل انفجاري مع العديد من المواد بما في ذلك الوقود، كما وقد يشتعل ثالث أكسيد ثنائي النيتروجين مع المواد القابلة للاحتراق.








