اقرأ في هذا المقال
- هيدروكسيد النيكل الثنائي
- خصائص مركب هيدروكسيد النيكل
- تحضير هيدروكسيد النيكل
- استخدامات هيدروكسيد النيكل
- معلومات عامة عن هيدروكسيد النيكل
في الكيمياء إن مركب هيدروكسيد النيكل الثنائي وفي الإنجليزية (Nickel(II) hydroxide) عبارة عن مركب بلوري غير عضوي أخضر اللون ينتج غازات سامة عند التسخين، ويستخدم في بطاريات النيكل- كادميوم كعامل مساعد في التفاعلات الكيميائية، يمتلك الصيغة الكيميائية التالية: (Ni(OH)2).
هيدروكسيد النيكل الثنائي
- إن مركب هيدروكسيد النيكل، وهو أحد مركبات النيكل غير العضوية، وهو مادة مهمة في كلا من مساقي الفيزياء والكيمياء، كما أنه يمتلك العديد من التطبيقات في الهندسة بما في ذلك إلى حد كبير البطاريات، وفي البداية هناك تراكيب لشكلين معروفين والمشار إليها باسم ألفا (α-Ni (OH)2) وبيتا (β-Ni (OH)2)، كما وأن هناك أنواع مختلفة من الاضطرابات والتي توجد بشكل متكرر في مواد هيدروكسيد النيكل بما في ذلك الماء واضطراب خطأ التراص بالإضافة إلى الضغوط الميكانيكية ودمج الشوائب الأيونية.
- في عدة من الأوراق النقاشية تمت مناقشة العديد من المواد ذات الصلة بما في ذلك مشتقات ألفا المقحمة وأملاح النيكل الأساسية، وبعد ذلك تم تلخيص عدد من الطرق لتحضير أو تخليق هيدروكسيدات النيكل بما في ذلك عمليات الترسيب الكيميائي والترسيب الكهروكيميائي، وتخليق محلول الهلام والتقادم الكيميائي بالإضافة إلى التوليف الحراري المائي والحراري المذاب والأكسدة الكهروكيميائية والتوليف بمساعدة الميكروويف والطرق الصوتية أيضا.
- أخيرًا تمت مراجعة الخصائص الفيزيائية المعروفة لهيدروكسيدات النيكل بما في ذلك خواصها المغناطيسية والاهتزازية والبصرية والكهربائية والميكانيكية، لاحقا سوف نقدم ملخص لكل من الخصائص المفيدة المحتملة لهذه المواد، لقد تم استخدام مركب هيدروكسيد النيكل على شكل مادة مرجعية في الدراسة، حيث تمت دراسة تأثير أخطاء التراص على النشاط الكهروكيميائي لأقطاب (Ni (OH)2).
- يظهر مركب هيدروكسيد النيكل الثنائي على شكل مسحوق أخضر ناعم، ويعرف عنه بإنه قليل الذوبان في الماء وأكثر كثافة منه، أما الخطر الأساسي له فهو يتمثل بكونه تهديدا للبيئة، ويجب أن يتم اتخاذ خطوات فورية للحد من انتشاره في البيئة، وهيدروكسيد النيكل (II) هو قاعدة، والمحلول المائي منه عبارة عن مادة قلوية.
- إن مركب هيدروكسيد النيكل (II) عبارة عن مركب متماسك ببعضه البعض بواسطة روابط أيونية، كما أنه يمتلك هيكل أيوني عملاق، ويتفاعل هذا المركب مع الأحماض من أجل إنتاج ملح نيكل (II) كما في المعادلات الكيميائية التالية:
- حمض الهيدروكلوريك + نيكل (II) هيدروكسيد ← نيكل (II) كلوريد + ماء
2HCl + Ni (OH) 2 → NiCl2 + H2O - حمض الكبريتيك + هيدروكسيد نيكل (II) ← نيكل (II) كبريتات + ماء
H2SO4 + Ni (OH) 2 → NiSO4 + 2H2O - حمض النيتريك + نيكل (II) هيدروكسيد ← نيكل (II) نترات + ماء
2HNO3 + Ni (OH) 2 → Ni (NO3) 2 + H2O
- حمض الهيدروكلوريك + نيكل (II) هيدروكسيد ← نيكل (II) كلوريد + ماء
- في الجدول التالي سيتم ذكر نسب وجود كلا من عناصر النيكل والهيدروجين والأكسجين في مركب هيدروكسيد النيكل (Ni(OH)2)، علما أنه يمتلك كتلة مولية مقدارها 92.70808 غرام لكل مول:
| العنصر الكيميائي | الرمز الكيميائي | الكتلة المولية | عدد الذرات | نسبة وجود العنصر |
| النيكل | Ni | 58.6934 غرام لكل مول | 1 | 63.310% |
| الهيدروجين | H | 1.00794 غرام لكل مول | 2 | 2.174% |
| الأكسجين | O | 15.9994 غرام لكل مول | 2 | 34.516% |
خصائص مركب هيدروكسيد النيكل
- إن مركب هيدروكسيد النيكل الثنائي هو عبارة عن بلورة سداسية خضراء، حيث يمتلك كثافة مقدارها 4.10 جم لكل سم مكعب، ويتحلل هذا المركب عند التسخين عند درجة حرارة مقدارها 230 درجة مئوية إلى مركب أكسيد النيكل ذو الصيغة الكيميائية التالية: (NiO)، وهو غير قابل للذوبان في الماء، كما أنه يمتلك ثابت ذائبية مقداره (KSP 5.47×10-16)، ومركب أحادي الهيدرات منه غير قابل للذوبان في الماء ولكنه قابل للذوبان في كلا من الأحماض المخففة والأمونيا.
- إن عملية التحلل الحراري لمركب هيدروكسيد النيكل (II) تؤدي لإنتاج أكسيد النيكل (II) والماء، علما أنه يحدث هذا التفاعل عند درجة حرارة 230-360 درجة مئوية، كما في المعادلة الكيميائية التالية:
Ni(OH)2 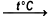 NiO + H2O
NiO + H2O
تحضير هيدروكسيد النيكل
- يتم تحضير مركب هيدروكسيد النيكل الثنائي بطرق مختلفة تتضمن في الغالب تفاعل الصودا الكاوية أو البوتاس الكاوية مع ملح النيكل القابل للذوبان، وهكذا فإن عملية معالجة محلول كبريتات النيكل بهيدروكسيد الصوديوم يشكل مادة هلامية خضراء ضخمة.
- يتبلور الجل عند التخزين المطول، وبدلاً من ذلك فإن المحلول عند التعادل يشكل راسبًا ناعمًا من هيدروكسيد النيكل، علما أنه يتم استخدام مادة نترات النيكل أيضًا كمواد أولية من أجل تحضير هيدروكسيد النيكل، وينتج محلولها المائي عندما تتم معالجته باستخدام هيدروكسيد الصوديوم أو البوتاسيوم راسب هلامي من هيدروكسيد النيكل من الممكن أن يتم استخلاصه بالكحول الساخن من أجل تكوين منتج عالي النقاء.
- يتم تحضير مركب هيدروكسيد النيكل بدرجة نقاء عالية بواسطة عملية التحليل الكهربائي، وذلك يتم باستخدام النيكل المعدني كمحلول الأنود ونترات النيكل كمحلول إلكتروليت، ويتم ترسيب مركب هيدروكسيد النيكل كهربيًا عند كاثود خامل.
- يترسب هذا المركب على صورة مسحوق أخضر مقسم بدقة عندما يضاف محلول هيدروكسيد فلز قلوي إلى محلول مائي من ملح نيكل (II)، حيث أنه غالبًا ما يكون من الصعب التصفية في البداية ولكنها تصبح أكثر بلورية عند الوقوف لفترات طويلة، وإذا تم ترسيب ملح النيكل بشكل غير كامل خاصة إذا تم استخدام محاليل قوية جدًا من النيكل (II)، فقد يكون الراسب عبارة عن ملح أساسي، وهذا صحيح بشكل خاص للهاليدات وفي هذه الحالة تم تمييز مركبات مثل (NiCl2 , 3Ni(OH)2) و (NiCl2 , Ni(OH)2).
استخدامات هيدروكسيد النيكل
- نظرًا لسلوك الأكسدة والاختزال، فإنه يتم استخدام مركب هيدروكسيد النيكل في أقطاب البطارية القابلة لإعادة الشحن، كما أنه مفيد من أجل تخزين الطاقة الكهروكيميائية، ومع التطبيقات المحتملة في بطاريات السيارات، وهو أيضا عبارة عن مادة محتملة للعديد من التطبيقات البيولوجية، على سبيل المثال في مقايسة الصبغيات (DNA).
- أما عن أساليب الإنتاج فإنه يتم الحصول على هيدروكسيد النيكل إما بمعالجة محلول كبريتات النيكل بهيدروكسيد الصوديوم أو باستخلاص الكحول الساخن من الراسب المتكون نتيجة تفاعل نترات النيكل مع هيدروكسيد البوتاسيوم، حيث أنه يتم استخدام هيدروكسيد النيكل في عملية تصنيع الخلايا الكهربائية من النيكل والكادميوم، وكمنتج وسيط أثناء تصنيع محفزات النيكل.
معلومات عامة عن هيدروكسيد النيكل
- إن مركب هيدروكسيد النيكل خطر، وهو عبارة عن مادة مسرطنة مؤكدة، أي أنه مادة مسرطنة مؤكدة مع البيانات التجريبية المسببة للسرطان والأورام، وهو سم من خلال الطريق تحت الجلد، أما من ناحية التعرض المحتمل فإنه من الممكن العثور عليها في مكان العمل كغبار أو سائل أو محلول حمضي، ويمكن استخدام هذا المركب في عمليات طلاء النيكل، وهو غير متوافق مع الأحماض القوية.








