في الكيمياء إن مركب كلورات الليثيوم وفي الإنجليزية (lithium chlorate) عبارة عن أحد المركبات الكيميائية، يندرج ضمن فئة المركبات غير العضوية (inorganic compounds)، يتكون من ثلاثة ذرات من الأكسجين وذرة واحدة من الليثيوم وواحدة من الكلور، يمتلك الصيغة الكيميائية التالية: (LiClO3)، وعندما يكون في الحالة النقية فإنه يكون على صورة كرستالات بيضاء اللون أبرية المظهر.
كلورات الليثيوم
- إن مادة كلورات الليثيوم عبارة عن أحد المركبات غير العضوية، ومثل جميع الكلورات فهو يعد عبارة عن عامل أكسدة وقد يصبح غير مستقر، كما وأنه من المحتمل أن يكون متفجرًا إذا تم مزجه بمواد عضوية أو حتى مساحيق معادن متفاعلة أو مع الكبريت.
- من الممكن أن يتم تصنيع مركب كلورات الليثيوم من خلال حدوث تفاعل بين هيدروكسيد الليثيوم المركّز الساخن مع الكلور كما في المعادلة الكيميائية التالية:
3Cl2 + 6 LiOH → 5 LiCl + LiClO3 + 3 H2O
معلومات عامة عن مركب كلورات الليثيوم
- في الحقيقة فإنه تتمتع مادة كلورات الليثيوم بقابلية عالية للذوبان في الماء، وهي أيضًا مؤكسدة بستة إلكترونات، وتحتوي مادة كلورات الليثيوم (LiClO3) على نقطة انصهار تبلغ قيمتها 127.6 درجة مئوية أو قد تصل إلى 129 درجة مئوية، علما أن مقدار الموصلية المحددة لمادة كلورات الليثيوم المنصهرة تكون عالية نسبيًا عند المقارنة بمعظم المحاليل الإلكتروليتية التي يتم استخدامها في درجة حرارة الغرفة.
- وتبعا لما سبق، فإنه توفر مادة كلورات الليثيوم فرصة من أجل عملية تشغيل نظام بطارية ليثيوم جديد عند درجة حرارة تتراوح بين درجات حرارة مقدارها 130 درجة مئوية و 150 درجة مئوية، كما وقد وجد من التجارب أن مادة كلورات الليثيوم تكون عبارة عن مادة مستقرة في النطاق المحتمل بين 3.2 فولت و 4.6 فولت بالنسبة للقطب المرجعي الليثيوم (Li).
- يتمتع نظام بطارية (Li-Cl2) الثانوي بإمكانية دائرة مفتوحة تبلغ 3.97 فولت، مما يجعل بطارية (Li-Cl2) الثانوية في كلورات الليثيوم المنصهرة من حيث المبدأ ممكنة الحدوث، ومن الممكن أيضًا أن يتم استخدام نظام بطارية أولية لكلورات الليثيوم.
- يتم إعاقة أداء القطب السالب لليثيوم بسبب كلا من التآكل والتفاعلات الجامحة المحتملة مع مركب كلورات الليثيوم (LiClO3) وتشكيل التغصنات عند الشحن، علما أن قابلية ذوبان كلا من المركبات التالية: أكسيد الليثيوم (Li2O) ومركب كلوريد الليثيوم (LiCl) في كلورات الليثيوم (LiClO3) عند درجة حرارة مقدارها 145 درجة مئوية هي .000075 و .00178 على التوالي.
- ومن ناحية التحلل الحراري لمادة كلورات الليثيوم فهو يتم كما في التفاعل الكيميائي التالي، إذ يتحلل إلى مركب كلوريد الليثيوم والأكسجين، ويحدث هذا التفاعل عند درجة حرارة قريبة من درجة 400 درجة مئوية حوالي 250 درجة مئوية، وفي وجود محفز أكسيد المنغنيز (MnO2):
2LiClO3 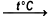 2LiCl + 3O2
2LiCl + 3O2
- لقد تمت عملية دراسة حركية تحلل (Kinetics of LiClO4 decomposition) مركب كلورات الليثيوم (LiClO4) تحت تأثير كلا من أكاسيد الليثيوم التاليين: (Li2O) و (Li2O2) في نطاق درجة حرارة من 280 إلى 310 درجة مئوية، حيث أنه تتكون العملية التحفيزية من تفاعلين متتاليين (LiClO4 -> LiClO3 -> LiCl).
- إذ أنه في البداية يتحلل مركب بيروكسيد الليثيوم إلى أكسيد الليثيوم (Li2O) والأكسجين (O2) في وقت واحد مع أنيون (chlorooxygen) ويعمل أكسيد الليثيوم على تكثيف تحلل بيركلورات الليثيوم بواسطة العامل (102-103)، ويتم الوصول إلى معدل التحلل نفسه في وجود (Li2O) بمقدار 100 درجة مئوية أقل من الملح النقي.
- علما أن العمل التحفيزي لأكسيد الليثيوم على تحلل (LiClO4 أكثر طفيفة)، وفي وجود مركب (Li2O) فإن مادة بيركلورات الليثيوم تتحلل أسرع مرتين من كلورات الليثيوم، بينما في الحالة النقية تتحلل الكلورات أسرع بخمس مرات.
- لقد تم تحديد مخطط التوازن لنظام كلورات الليثيوم مع الماء في جميع درجات الحرارة وتلك الخاصة بنظام كلورات الليثيوم – كلوريد الليثيوم – الماء عند درجات حرارة 3.0 درجة و 6.0 درجات و 8.5 درجة و 25.0 درجة مئوية، ووجد أن المركب الأول ذو الصيغة الكيميائية التالية: ((LiClO3) 4.H2O) مستقر عند ملامسته للمحلول من 20.5 درجة إلى 42.0 درجة مئوية.
- والمركب ذو الصيغة الكيميائية التالية (LiClO3.H2O) مستقر عند ملامسته للمحلول من -0.1 درجة إلى 20.5 درجة مئوية بينما المركب ذو الصيغة التالية (LiClO3.3 H2O) يذوب بشكل متطابق عند 8.4 درجة مئوية، وقد اكتشف بيرج الهيدرات لكنه أعطاه الصيغة ((LiClO3) 3.H2O)، وكلورات الليثيوم وكلوريد الليثيوم لا تشكل أملاح مزدوجة في درجات حرارة التحقيق.
- توجد مادة كلورات الليثيوم في شكلين متجهين للحيوية، وهما الشكل ألفا (α) ويحدث الانتقال بين الشكل ألفا والشكل بيتا (α ↔ β) عند درجة حرارة مقدارها 99.8 درجة مئوية، علما أن الشكل ألفا يمتلك كثافة أقل، والشكل غاما (γ)، والذي قد اقترحه كلا من كراوس وبورجيس، غير موجود بشكل ثابت أو أنه غير مستقر، علما أنه تم الحصول على نمط حيود الأشعة السينية لمركب كلورات الليثيوم من نوع بيتا (β-LiClO3).









